1. que es un hidrocarburo
Los hidrocarburos son compuestos orgánicos formados únicamente por átomos de carbono e hidrógeno. Consisten en un armazón de carbono al que se unen átomos de hidrógeno. Forman el esqueleto de la materia orgánica. También están divididos en abiertas y ramificadas.
Los hidrocarburos se dividen en 2 que son aromáticos y alifáticos. Los alifáticos son alcanos, alquenos y alquinos cuyas fórmulas generales son CnH2n+2, CnH2n y CnH2n-2, respectivamente.
Las intoxicaciones por hidrocarburos tienden a causar cuadros respiratorios relativamente severos. La gasolina, el queroseno y los aceites para pulir muebles, que contienen hidrocarburos, son los agentes más comunmente usados en las intoxicaciones. El tratamiento a menudo requiere intubación y ventilación mecánica. Inducir el vómito en estos sujetos está contraindicado porque puede causar más daño esofágico.
2.como es el proceso de explotacion del petroleo
¿DÓNDE SE ENCUENTRA EL PETRÓLEO?Generalmente se encuentra encerrado en los espacios que hay entre los granos de arena que forman las rocas llamadas areniscas, que pueden ser de origen marino, fluvial, glacial o lacustre.Cuando estas areniscas son "petrolíferas", el petróleo se encuentra ocupando los poros de éstas al igual que el agua en una esponja. También es posible encontrar petróleo en grietas y cavidades y en otras rocas sedimentarias como las calizas y dolomitas.Debido a los intensos movimientos telúricos ocurridos en el pasado geológico, las rocas sufrieron deformaciones que produjeron, en algunos casos, "trampas". Estas son condiciones estructurales o estratigráficas más favorables para una mayor acumulación de petróleo dentro de la roca contenedora, dando origen a un yacimiento o acumulación comercial de hidrocarburo.Dentro del yacimiento, como consecuencia de sus diferentes pesos específicos, encontramos al petróleo acumulado sobre el agua salada, que siempre lo acompaña, y por debajo del gas natural, que ocupa la parte superior de la trampa.
Las reservas petrolíferas se encuentran bajo la superficie terrestre a cientos o a miles de metros de profundidad y el único método seguro para ubicarlas, son los Sondajes Exploratorios.Hoy en día, la técnica más utilizada para extraer el petróleo de los pozos es mediante la perforación rotatoria. Este método emplea tubos cilíndricos de acero (barras de perforación) acoplados a un tambor o mesa rotatoria mediante la cual se les imprime una rápida rotación.
¿CÓMO SE EXTRAE EL PETRÓLEO?Un pozo que ha sido perforado y entubado hasta llegar a la zona donde se encuentra el petróleo, está listo para empezar a producir.Desde los separadores, por medio de cañerías, el crudo es enviado a los aparatos especiales donde se separan de él el gas y el agua.A través de otras cañerías, conocidas como gasoductos se conduce el gas a diferentes sitios para su empleo como combustible o para tratamiento posterior y otras cañerías (oleoductos) conducen el petróleo a los estanques de almacenamiento desde donde se les envía a su destino.
¿CÓMO SE TRATA EL PETRÓLEO?En los primeros tiempos, la refinación se contentaba con separar los productos preexistentes en el crudo, sirviéndose de su diferencia de volatilidad, es decir, del grosor de una molécula. Fue entonces cuando se aprendió a romperlas en partes más pequeñas llamadas "de cracking", para aumentar el rendimiento en esencia, advirtiéndose que ellas y los gases subproductos de su fabricación tenían propiedades "reactivas".
El pasado siglo, los franceses de Alsacia refinaron el petróleo de Pechelbronn, calentándolo en una gran "cafetera". Así, por ebullición, los productos más volátiles se iban primero y a medida que la temperatura subía, le llegaba el turno a los productos cada vez más ligeros. El residuo era la brea de petróleo o de alquitrán. Asimismo, calcinándolo, se le podía transformar en coque, excelente materia prima para los hornos metalúrgicos de la época.Los ingenieros americanos y germanos introdujeron los alambiques en cascada, sistema en que cada cilindro era mantenido a una temperatura constante. El petróleo penetraba en el primero y una vez rescatado lo que podía evaporarse, pasaba al siguiente, que se encontraba a temperatura más alta y así sucesivamente hasta el último, desde el cual corría la brea.El principio básico en la refinación del crudo radica en los procesos de destilación y de conversión, donde se calienta el petróleo en hornos de proceso y se hace pasar por torres de separación o fraccionamiento y plantas de conversión. En las distintas unidades se separan los productos de acuerdo a las exigencias del mercado.
3.cual es la formula de de cada uno de los hidrocarburos acano alquenos y alquinos
ALCANOS CnH2n mas 2
ALQUENOS CnH2n
ALQUINOS CnH2n-2
lunes, 12 de abril de 2010
afinidad electronica

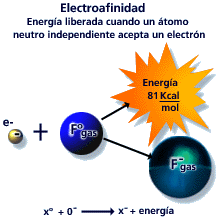
La afinidad electrónica (AE) o electroafinidad se define como la energía involucrada cuando un átomo gaseoso neutro en su estado fundamental (de mínima energía) captura un electrón y forma un ión mononegativo: . Dado que se trata de energía liberada, tiene signo negativo. En los casos en los que la energía sea absorbida, tendrá signo positivo.
La Electroafinidad aumenta cuando el tamaño del átomo disminuye, el efecto pantalla aumenta y cuando el nº atómico disminuye. Visto de otra manera: aumenta de izquierda a derecha, y de abajo hacia arriba, al igual que lo hace la electronegatividad. En la tabla periódica tradicional no es posible encontrar esta información.
O bien el cambio de energía que ocurre cuando un átomo en estado gaseoso acepta un electrón para formar un ion.
Se define la entalpía de ganancia de electrones como la variación de la energía asociada a la ganancia de un electrón por un átomo en estado gaseoso:
A(g) + e-(g) → A-(g) ΔHge
Esta entalpía puede ser positiva o negativa (reacción endotérmica o exotérmica, respectivamente). Sin embargo, aunque DHge es el término termodinámico apropiado para describir este proceso, en Química Inorgánica se suele emplear más frecuentemente una propiedad íntimamente relacionada con la anterior, denominada afinidad electrónica Ae, que se define como la diferencia en energía expresada a continuación:
Ae = E(A, g) - E(A-,g)
A T = 0 K, la afinidad electrónica es el valor, cambiado de signo, de la entalpía de ganancia de electrones (Ae= -ΔHge). Un valor positivo de la afinidad electrónica indica que el ion A- tiene una menor y, por tanto más favorable, energía que el átomo neutro A. Como ocurre con la energía de ionización, la afinidad electrónica se suele expresar en eV.
La afinidad electrónica de un elemento está determinada, en parte, por la energía del orbital desocupado, o parcialmente ocupado, de menor energía en el estado fundamental del átomo. Este orbital es uno de los denominados orbitales frontera de un átomo; otro orbital frontera corresponde al orbital lleno de mayor energía. Los orbitales fronteras de un átomo están implicados en los cambios electrónicos que se producen cuando se forman los enlaces químicos.
Orbitales Frontera
Un elemento posee una elevada afinidad electrónica si el electrón adicional ocupa una capa en la que experimenta una elevada carga nuclear efectiva. Este es el caso de los elementos que se encuentran en la parte superior derecha de la Tabla Periódica. Estos elementos próximos al flúor (específicamente el nitrógeno, el oxígeno y el cloro) son los que poseen los mayores valores de Ae. La segunda afinidad electrónica, o energía de adición de un segundo electrón, para un elemento es siempre positiva porque las repulsiones interelectrónicas son mayores que las fuerzas de atracción por el núcleo.
La Electroafinidad aumenta cuando el tamaño del átomo disminuye, el efecto pantalla aumenta y cuando el nº atómico disminuye. Visto de otra manera: aumenta de izquierda a derecha, y de abajo hacia arriba, al igual que lo hace la electronegatividad. En la tabla periódica tradicional no es posible encontrar esta información.
O bien el cambio de energía que ocurre cuando un átomo en estado gaseoso acepta un electrón para formar un ion.
Se define la entalpía de ganancia de electrones como la variación de la energía asociada a la ganancia de un electrón por un átomo en estado gaseoso:
A(g) + e-(g) → A-(g) ΔHge
Esta entalpía puede ser positiva o negativa (reacción endotérmica o exotérmica, respectivamente). Sin embargo, aunque DHge es el término termodinámico apropiado para describir este proceso, en Química Inorgánica se suele emplear más frecuentemente una propiedad íntimamente relacionada con la anterior, denominada afinidad electrónica Ae, que se define como la diferencia en energía expresada a continuación:
Ae = E(A, g) - E(A-,g)
A T = 0 K, la afinidad electrónica es el valor, cambiado de signo, de la entalpía de ganancia de electrones (Ae= -ΔHge). Un valor positivo de la afinidad electrónica indica que el ion A- tiene una menor y, por tanto más favorable, energía que el átomo neutro A. Como ocurre con la energía de ionización, la afinidad electrónica se suele expresar en eV.
La afinidad electrónica de un elemento está determinada, en parte, por la energía del orbital desocupado, o parcialmente ocupado, de menor energía en el estado fundamental del átomo. Este orbital es uno de los denominados orbitales frontera de un átomo; otro orbital frontera corresponde al orbital lleno de mayor energía. Los orbitales fronteras de un átomo están implicados en los cambios electrónicos que se producen cuando se forman los enlaces químicos.
Orbitales Frontera
Un elemento posee una elevada afinidad electrónica si el electrón adicional ocupa una capa en la que experimenta una elevada carga nuclear efectiva. Este es el caso de los elementos que se encuentran en la parte superior derecha de la Tabla Periódica. Estos elementos próximos al flúor (específicamente el nitrógeno, el oxígeno y el cloro) son los que poseen los mayores valores de Ae. La segunda afinidad electrónica, o energía de adición de un segundo electrón, para un elemento es siempre positiva porque las repulsiones interelectrónicas son mayores que las fuerzas de atracción por el núcleo.
Suscribirse a:
Entradas (Atom)
